5. Compuestos quimicos
Compuestos químicos
La molécula es la partícula más pequeña que presenta todas las propiedades físicas y químicas de una sustancia, y se encuentra formada por dos o más átomos.
Los átomos que forman las moléculas pueden ser iguales (como ocurre con la molécula de oxígeno, que cuenta con dos átomos de oxígeno) llamadas moleculas elementales o distintos (la molécula de agua, por ejemplo, tiene dos átomos de hidrógeno y uno de oxígeno) moléculas compuestas.
Un compuesto es un grupo definido de átomos unidos por enlaces químicos. Para ilustrarlo mejor, considera los dos tipos principales de enlace químico: enlaces covalentes y enlaces iónicos. En los enlaces covalentes, dos átomos comparten pares de electrones, mientras que en los enlaces iónicos, los electrones se transfieren completamente entre dos átomos por lo que se forman iones.
Representación de moléculas: fórmulas químicas
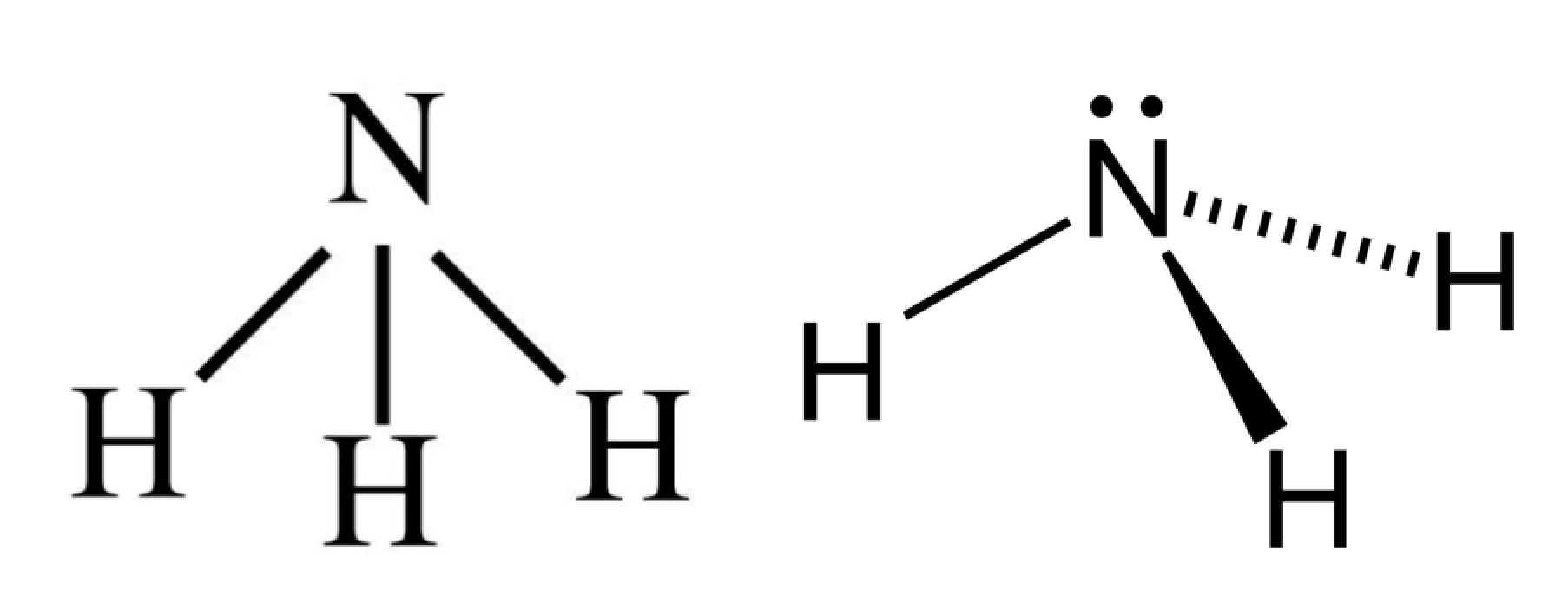
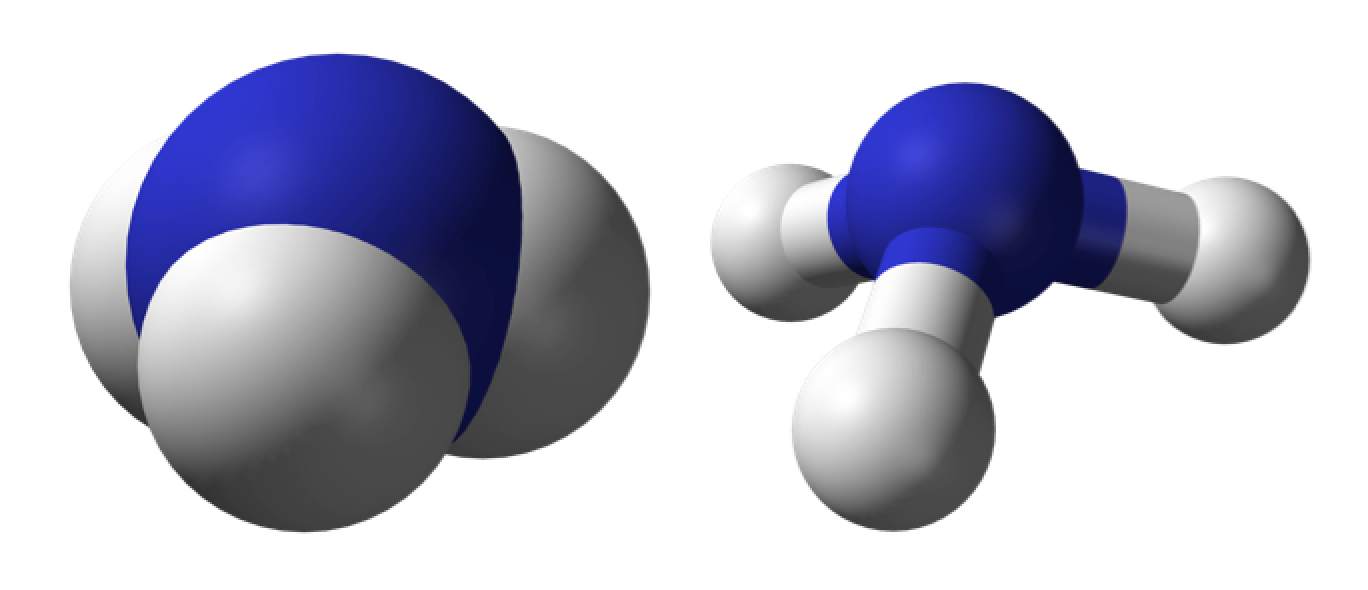
- Fórmula química o molecular, son la forma más simple de representar moléculas. Utilizamos los símbolos de los elementos para indicar qué elementos están presentes, y usamos subíndices para indicar cuántos átomos de cada elemento existen dentro de la molécula. Por ejemplo, una sola molécula de NH3 amoniaco, contiene un átomo de nitrógeno y tres átomos de hidrógeno
- Formula estructural, dan información sobre cómo se conectan los átomos en el espacio. Formula estructural del amoniaco NH3)
- Compuestos binarios: Son aquellas especies formadas por dos átomos diferentes, pertenecen a los compuestos binarios familias como los óxido metálico, oxido no metálico, sal binaria, hidruros, hidrácidos Ejemplos NaCl, H2O, Fe2O3, Mg2O6, HCl, HI, FeH.
- Compuestos ternarios: Éstos compuestos están constituidos por tres átomos diferentes en su estructura, algunos ejemplos de familias a las que pertenecen los compuestos ternarios son: oxácidos, hidróxidos, sales ternarias y sales ternarias de amonio . Ejemplos H2SO4, H4P2O7, HClO, SO4, P2O7, ClO
- Compuestos cuaternarios: Están compuestos por 4 átomos diferentes, y suelen ser sales cuaternarias y sales de amonio que han ganado o perdido algún hidrógeno, son las llamadas sales ácidas o sales básicas respectivamente. Ejemplos PbCO3(OH)2, Cr(HSO4)3, NaHCO3, ZnIOH, Cu2(OH)2SO3, Li2KAsO4
ACTIVIDAD
1. Identifica
2. Nomenclatura
Tabla Periódica y valencia


Comentarios
Publicar un comentario